
Wejście na rynek nowego leku poprzedza zazwyczaj kilkanaście lat prac badawczo-rozwojowych, w które zaangażowane są duże, interdyscyplinarne zespoły naukowców. Średnio w pracach nad rozwojem leku innowacyjnego na przestrzeni lat, pracuje nawet 1000 naukowców. Ocenia się, że łączny koszt wprowadzenia nowego leku na rynek to do 8 miliardów złotych. W trosce o bezpieczeństwo pacjentów, m.in. ze względu na zaostrzanie wymogów, dotyczących procedur badawczo-diagnostycznych czy sposobu przeprowadzania badań klinicznych, koszty te wciąż wzrastają.
Jak powstaje innowacyjny lek
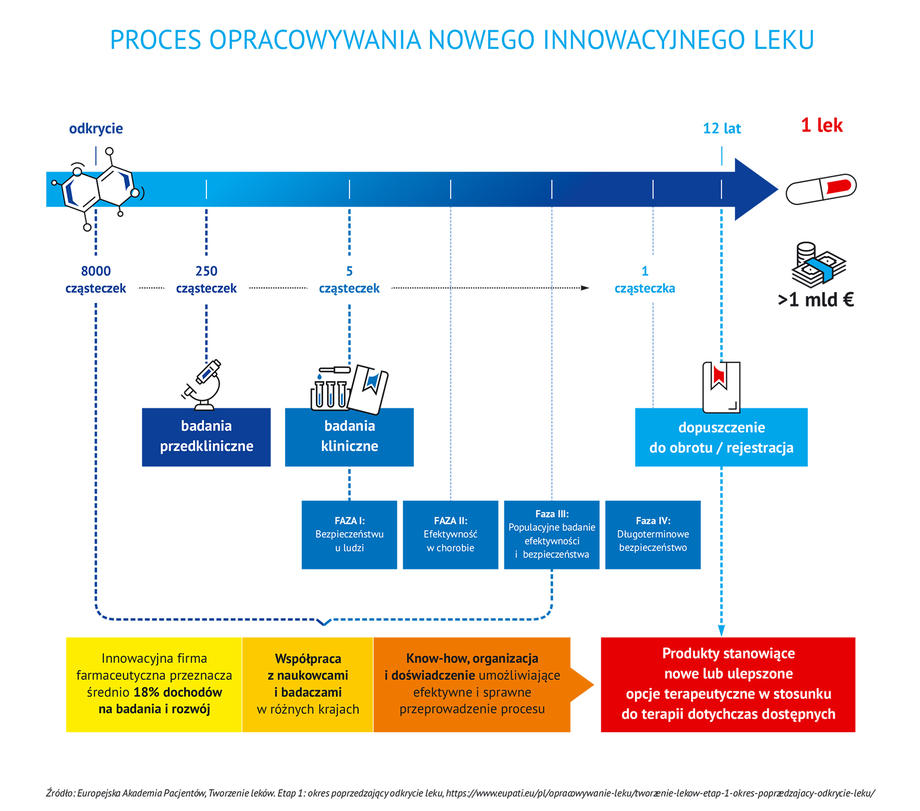
Proces tworzenia leku innowacyjnego rozpoczyna się od próby zrozumienia mechanizmu danej choroby. Następnie badacze szukają sposobu, dzięki któremu rozwój choroby będzie można cofnąć lub zahamować. Wymaga to podjęcia wielu prób, bardzo często zakończonych niepowodzeniem.
Tylko jedna na 8 000 badanych cząsteczek daje szansę na stworzenie nowego leku.
Pierwszy etapem prac nad stworzeniem nowego leku są badania laboratoryjne. Spośród tysięcy cząsteczek tylko kilkaset – tych o największym potencjale terapeutycznym – przechodzi z tej fazy do fazy badań przedklinicznych. Substancje, które zostały pozytywnie ocenione w laboratorium, są następnie podawane zwierzętom (zazwyczaj dwóm gatunkom, np. szczurom i psom). Zaczynają się obserwacje, jak substancja oddziałuje na żywy organizm i czy nie jest dla niego szkodliwa. Ta faza badań trwa ok. 5-8 lat. Kilka cząsteczek spośród testowanych w badaniach przedklinicznych ma szansę przejść do następnego etapu, czyli czterech faz badań klinicznych z udziałem ludzi. Te badania prowadzone są w celu potwierdzenia skutków działania leków lub w celu zidentyfikowania działań niepożądanych, a także śledzenia wchłaniania, metabolizmu i wydalania leków, mając na względzie ich bezpieczeństwo i skuteczność. Badania kliniczne podzielone są na cztery fazy.
W fazie pierwszej, której celem jest wstępne określenie bezpieczeństwa i dawkowania bierze udział od 20 do 100 zdrowych ochotników lub osób chorych. Około 70% leków przechodzi do kolejnej fazy. W kolejnym etapie lek, w celu określenia skuteczności i działań niepożądanych, poddawany jest badaniom na grupie do kilkuset chorych osób. Około 33% leków badanych w fazie 2. przechodzi do kolejnej fazy. Tu uczestniczy od 300 do 3000 chorujących ochotników, a celem badania jest dalsze weryfikowanie skuteczności i monitorowanie działań niepożądanych. Do fazy ostatniej przechodzi około 25-30% leków. W 4. fazie na grupie kilku tysięcy ochotników, cierpiących na daną jednostkę chorobową bada się bezpieczeństwo i skuteczność leku innowacyjnego.
Aby nowy lek trafił do codziennej praktyki medycznej, po potwierdzeniu badaniami klinicznymi skuteczności terapeutycznej i bezpieczeństwa musi przejść jeszcze długi i skomplikowany proces rejestracji, wymagający przedłożenia szczegółowych analiz i raportów dokumentujących skuteczność i bezpieczeństwo oraz jakość leku.
Motywacja dla innowatorów
Innowacyjna firma farmaceutyczna przeznacza średnio 18% swoich dochodów na badania i rozwój. By zachęcić firmy do inwestowania w badania i rozwój oraz przeznaczanie wysokich nakładów, zarówno finansowych jak i czasowych, związanych z odkryciem i wprowadzeniem na rynek nowych cząsteczek, leki innowacyjne są chronione m.in. na podstawie krajowych i europejskich przepisów patentowych związanych z ochroną własności intelektualnej oraz na podstawie przepisów Prawa farmaceutycznego. Ochrona patentowa przez 20 lat obejmuje innowacyjną substancję czynną leku lub proces wytwarzania i jest udzielana już na bardzo wczesnym etapie rozwoju leku, czasami nawet kilkanaście lat przed wprowadzeniem innowacyjnego leku na rynek.
Przepisy polskiego Prawa farmaceutycznego określają, że przez osiem lat od momentu wydania pozwolenia na dopuszczenie do obrotu leku oryginalnego chroniona jest dokumentacja dotycząca wyników badań klinicznych i nieklinicznych. Odpowiednik nie może trafić do sprzedaży wcześniej niż przed upływem 10 lat od daty wprowadzenia na rynek leku oryginalnego.
Leki oryginalne a ich odpowiedniki
Lek generyczny, potocznie zwany odpowiednikiem, to lek, który opracowano, by uzyskać skutek terapeutyczny odpowiadający już zarejestrowanemu lekowi innowacyjnemu. Odpowiednikiem jest produkt leczniczy posiadający taki sam skład jakościowy i ilościowy substancji czynnych, taką samą postać farmaceutyczną i którego biorównoważność wobec leku oryginalnego została potwierdzona odpowiednimi badaniami biodostępności.
Jeśli zakres wskazań leku generycznego jest zgodny ze wskazaniami leku innowacyjnego to jego producent nie musi wykonywać już zaawansowanych badań nieklinicznych i klinicznych. W takim przypadku do oceny leku generycznego wykorzystuje się wyniki badań nieklinicznych i klinicznych wykonane dla leku innowacyjnego.
W związku ze znaczenie uproszonym procesem rozwoju leków generycznych, nakłady z nim związane są nieporównywalnie niższe niż ma to miejsce w przypadku leków innowacyjnych. Producenci tych leków, nie ponoszą ogromnego ryzyka i inwestują mniej środków w opracowanie leku generycznego niż producenci leków oryginalnych. Dlatego też, mogą zaproponować niższe ceny za swoje produkty.
„Musimy jednak pamiętać, że bez leków innowacyjnych, bez tych lat prób, wysiłków tysięcy badaczy rozwijających nowe leki nie byłoby postępu w farmakoterapii. Nie mielibyśmy możliwości leczenia chorób dotychczas nieuleczalnych, nie moglibyśmy pomagać pacjentom” – podkreśla Bogna Cichowska-Duma, Dyrektor Generalny Związku Innowacyjnych Firm Farmaceutycznych INFARMA. „Na rynku musi być miejsce zarówno dla leków innowacyjnych, jak i leków generycznych. Tylko w tej sytuacji pacjenci będą odpowiednio zabezpieczeni” – tłumaczy.
Źródła:
a) Ustawa z dnia 30 czerwca 2000 r. Prawo własności przemysłowej (tekst jedn. Dz. U. z 2017 r., poz. 776, ze zm.;);
b) Rozporządzenie Parlamentu Europejskiego i Rady nr 469/2009 z dnia 6 maja 2009 r. dotyczącego dodatkowego świadectwa ochronnego dla produktów leczniczych (Dz. U. UE L z dnia 16 czerwca 2009 r.);
c) Ustawa z dnia 6 września 2001 r. Prawo farmaceutyczne (Dz. U. z 2016 r., poz. 2142, ze zm.);
d) Dyrektywa Parlamentu Europejskiego i Rady nr 2001/83 z dnia 6 listopada 2001 r. w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi
e) Ochrona patentowa produktów leczniczych, Żaneta Pacud, Lex, Warszawa 2013
f) www.phrma.org
g) http://www.urpl.gov.pl/pl/produkty-lecznicze/badania-kliniczne
h) www.fda.gov
i) DiMasi et al., Jurnal of Health Economisc, January 2016
Więcej o procesie powstawania nowych leków – obejrzyj filmy:
The drug discovery process (PhRMA):
How a drug becomes a drug (NIH/NIAID):
Drug discovery and development process at Novartis:
From idea to medicine - drug development at Roche:




